Riassunto
I pesci (Ciclostomi e Pesci Ossei) sono tra gli animali che maggiormente caratterizzano gli ecosistemi fluviali. Per quanto riguarda l’Italia questo gruppo zoologico risulta particolarmente interessante in termini di biodiversità per l’elevato numero di specie endemiche e sub endemiche; numerose sono però le attività antropiche che recano danno all’ittiofauna e rendono critica la sua sopravvivenza. In relazione alla Direttiva Quadro sulle Acque 2000/60/CE la fauna ittica risulta uno degli elementi di qualità biologica su cui effettuare il monitoraggio dello stato ambientale dei corsi d’acqua.
PAROLA CHIAVE: Fauna ittica/corsi d'acqua/Italia
Abstract
Fishes in the Italian rivers
Fishes (cyclostome and bone fishes) are the animals that mainly characterize river ecosystems. In Italy this group is particularly interesting with respect to biodiversity, thanks to high number of endemic and sub endemic species. Many human activities threaten ichtyofauna, that, according to Water Directive 2000/60/EC, is one of the elements of biologic quality in water courses monitoring.
KEY WORDS: Fisher/rivers/Italy
Tutti i disegni sono di Titti De Ruosi. Quelli delle figure 4, 5 e 6 sono tratti dall’Iconografia dei Pesci delle acque interne d’Italia (Zeruniane De Ruosi, 2002), edita dal Ministero dell’Ambiente e dall’Istituto Nazionale per la Fauna Selvatica (oggi ISPRA).
I pesci dei corsi d'acqua italiani
I pesci sono tra gli animali che maggiormente caratterizzano gli ecosistemi fluviali: trascorrono tutta la loro vita nell’acqua e molti di essi svolgono l’intero ciclo biologico nei fiumi (mentre altri prediligono i laghi ed altri ancora migrano fra il mare e i corsi d’acqua). Molte specie rivestono una grande importanza per l’uomo essendo oggetto di pesca, sia per motivi professionali che dilettantistici, e di acquacoltura. In vari luoghi della Terra i pesci che vivono nei fiumi sono una parte fondamentale dell’alimentazione umana; la vita e il lavoro di molti uomini dipendono così da essi.
“Pesce” e “fauna ittica” sono termini generici di uso comune che non hanno un preciso significato zoologico. Considerando le acque interne europee possiamo restringere il campo ai rappresentanti di due distinte classi di vertebrati: i Ciclostomi (Cyclostomata) e i Pesci Ossei (Osteichthyes). Per quanto riguarda le “acque interne”, esse sono il complesso dei corpi idrici superficiali compresi entro la linea di costa. Convenzionalmente si considerano “acque dolci” quelle che presentano salinità inferiori allo 0,5‰. Non tutte le acque interne rientrano quindi nella categoria delle acque dolci; per questo è necessario definire chi sono i pesci d’acqua dolce e chi sono quelli delle acque interne, pur sapendo che non è sempre netto il confine fra i due gruppi.
I “pesci d’acqua dolce” sono l’insieme dei Ciclostomi e dei Pesci Ossei che compiono esclusivamente, o che sono in grado di compiere, il loro ciclo biologico nelle acque interne con salinità inferiore allo 0,5‰ e quei pesci che svolgono nelle acque interne una fase obbligata del loro ciclo biologico. Per quanto riguarda l’ittiofauna italiana, sono stati classificati in tre distinte categorie bio-ecologiche (GANDOLFI e ZERUNIAN, 1987): gli stenoalini dulcicoli, gli eurialini migratori obbligati, gli eurialini migratori facoltativi; nella tabella I sono riportate le loro caratteristiche ed alcuni esempi.
Tabella I. Classificazione bio-ecologica dei Pesci d’acqua dolce italiani. Tra parentesi sono riportati esempi di specie appartenenti a ciascuna categoria.
Stenoalini dulcicoli Pesci strettamente confinati nelle acque dolci, dove svolgono l’intero ciclo biologico
Eurialini migratori obbligati Pesci migratori che compiono obbligatoriamente una fase del ciclo biologico in mare ed una nelle acque dolci
Eurialini migratori facoltativi Pesci capaci di svolgere l’intero ciclo biologico sia nell’ ambiente marino costiero che nelle acque dolci (a) e pesci che in parte dell’areale si comportano da stenoalini dulcicoli e in altra parte da eurialini migratori anadromi (b)
a) ad ampia vagilità, cioè dotati di buone capacità di
compiere spostamenti all’interno di un sistema
idrografico (Barbo, Trota marmorata)
b) a ridotta vagilità, cioè dotati di modeste capacità di
compiere spostamenti all’interno di un sistema
idrografico (Cobite, Ghiozzo di ruscello)
a) anadromi, che si riproducono nelle acque dolci e si
accrescono in mare (Storione, Lampreda di mare)
b) catadromi, che si riproducono in mare e si accrescono
nelle acque dolci o, più in generale, nelle acque interne
(Anguilla)
a) lagunari ed estuariali
(Ghiozzetto di laguna, Latterino)
b) a diversa ecologia intraspecifica
(Alosa, Spinarello)
I “pesci delle acque interne” sono un gruppo più ampio che comprende i pesci d’acqua dolce più alcune specie di pesci marini eurialini che, pur potendo compiere l’intero ciclo biologico in mare, frequentano con regolarità le acque interne estuariali e lagunari per motivi trofici. La fauna ittica delle acque interne italiane si compone di 63 taxa, riportati nella tabella II con la nomenclatura scientifica riferita al nostro più recente lavoro di sintesi (ZERUNIAN, 2004); altri autori riportano un quadro tassonomico diverso, sia per motivi nomenclaturali, sia per l’elevazione al rango di specie alcune popolazioni italiane o gruppi di esse (vedi ad esempio BIANCO, 2014). Tranne il Carpione del Garda, la Trota lacustre, la Bottatrice e l’Agone, che vivono solo in ambienti lacustri, le altre specie sono rinvenibili nei corsi d’acqua. Nella tabella, in neretto sono evidenziati gli endemiti e i subendemiti. Per quanto riguarda i primi, il loro areale ricade interamente in territorio italiano; tra questi ci sono, ad esempio il Triotto (Rutilus erythrophthalmus), la Rovella (Rutilus rubilio) e il Ghiozzo di ruscello (Gobius nigricans) (fig. 1a, 1b, 2b). Nel caso dei subendemiti la gran parte del loro areale ricade in territorio italiano mentre in parte minore, con motivazioni geografiche e di modalità di colonizzazione, ricade in paesi limitrofi; è per esempio il caso del Ghiozzo padano (fig. 2a).
Tabella II. I Pesci delle acque interne italiane. Nella colonna centrale sono evidenziati in neretto gli endemiti e i subendemiti. Nell’ultima colonna è riportato un riferimento geografico relativo all’areale delle specie, semispecie e sottospecie endemiche o subendemiche: N, regioni del nord; C, regioni del centro; S, regioni del sud; I, una o entrambe le regioni insulari; per i subendemismi il riferimento geografico è riportato fra parentesi. Con l’asterisco sono evidenziate le specie che frequentano le acque interne solo per motivi trofici.
CLASSE, ORDINE, Famiglia, Genere eSpecie | NOME COMUNE ITALIANO ENDEMISMI (E SUBEND.) |
CYCLOSTOMATA
PETROMYZONTIFORMES
Petromyzontidae
Petromyzon marinus Linnaeus, 1758
Lampetra fluviatilis (Linnaeus, 1758)
Lampetra planeri (Bloch, 1784)
Lampetra zanandreai Vladykov, 1955 | LAMPREDA DI MARE
LAMPREDA DI FIUME
LAMPREDA DI RUSCELLO
LAMPREDA PADANA (N) |
STEICHTHYES
ACIPENSERIFORMES
Acipenseridae
Acipenser sturio Linnaeus, 1758
Acipenser naccarii Bonaparte, 1836
Huso huso (Linnaeus, 1758) |
STORIONE
STORIONE COBICE (N)
STORIONE LADANO
|
ANGUILLIFORMES
Anguillidae
Anguilla anguilla (Linnaeus, 1758) | ANGUILLA |
CLUPEIFORMES
Clupeidae
Alosa fallax (Lacépède, 1803) | ALOSA e AGONE
|
CYPRINIFORMES
Cyprinidae
Rutilus pigus(Lacépède, 1804)
Rutilus rubilio (Bonaparte, 1837)
Rutilus erythrophthalmus Zerunian, 1982
Leuciscus cephalus (Linnaeus, 1758)
Leuciscus souffia muticellus Bonaparte, 1837
Phoxinus phoxinus (Linnaeus, 1758)
Tinca tinca (Linnaeus, 1758)
Scardinius erythrophthalmus (Linnaeus, 1758)
Alburnus alburnus alborella (De Filippi, 1844)
Alburnusalbidus(Costa, 1838)
Chondrostoma soettaBonaparte, 1840
Chondrostoma genei(Bonaparte, 1839)
Gobio gobio(Linnaeus, 1758)
Barbus plebejusBonaparte, 1839
Barbus meridionaliscaninus Bonaparte, 1839
Cobitidae
Cobitis taeniabilineata Canestrini, 1865
Sabanejewia larvata(De Filippi, 1859)
Balitoridae
Barbatula barbatula (Linnaeus, 1758) | PIGO
ROVELLAC
TRIOTTON
CAVEDANO
VAIRONE N/C/S
SANGUINEROLA
TINCA
SCARDOLA
ALBORELLA (N/C)
ALBORELLA MERIDIONALE S
SAVETTAN
LASCA NC
GOBIONE
BARBO (N/C/S)
BARBO CANINO N/C
COBIT EN/C
COBITE MASCHERATO N
COBITE BARBATELLO |
ESOCIFORMES
Esocidae
Esox lucius Linnaeus, 1758 | LUCCIO |
SALMONIFORMES
Salmonidae
Salmo (trutta) truttaLinnaeus, 1758
Salmo (trutta)marmoratus Cuvier, 1817
Salmo (trutta)macrostigma (Duméril, 1858)
Salmo fibreniZerunian e Gandolfi, 1990
Salmo carpioLinnaeus, 1758
Salvelinusalpinus(Linnaeus, 1758)
Thymallusthymallus (Linnaeus, 1758) | TROTA FARIO e TROTA LACUSTRE
TROTA MARMORATA (N)
TROTA MACROSTIGMA (C/S/I)
CARPIONE DEL FIBRENO C
CARPIONE DEL GARDA N
SALMERINO
TEMOLO |
GADIFORMES
Gadidae
Lota lota(Linnaeus, 1758) | BOTTATRICE |
MUGILIFORMES
Mugilidae
Mugil cephalus Linnaeus, 1758
Liza ramada(Risso, 1826)
Liza aurata(Risso, 1810)
Liza saliens(Risso, 1810)
Chelon labrosus(Risso, 1826) | CEFALO*
MUGGINE CALAMITA*
MUGGINE DORATO*
MUGGINE MUSINO*
MUGGINELABBRONE*
ATHERINIFORMES |
ATHERINIFORMES
Atherinidae
Atherina boyeri Risso, 1810 | LATTERINO |
CYPRINODONTIFORMES
Cyprinodontidae
Aphanius fasciatus (Valenciennes, 1821) | NONO |
GASTEROSTEIFORMES
Gasterosteidae
Gasterosteus aculeatus Linnaeus, 1758
Syngnathidae
Syngnathus acus Linnaeus, 1758
Syngnathusabaster Risso, 1810 | SPINARELLO
PESCE AGO*
PESCE AGO DI RIO |
SCORPAENIFORMES
Cottidae
Cottusgobio Linnaeus, 1758 | SCAZZONE |
PERCIFORMES
Moronidae
Dicentrarchus labrax (Linnaeus, 1758)
Percidae
Perca fluviatilisLinnaeus, 1758
Sparidae
Sparus auratus Linnaeus, 1758
Blenniidae
Salaria pavo(Risso, 1810)
Salaria fluviatilis(Asso, 1801)
Gobiidae
Pomatoschistusmarmoratus (Risso, 1810)
Pomatoschistusminutus elongatus(Canestrini, 1861)
Pomatoschistuscanestrini (Ninni, 1883)
Pomatoschistus tortonese iMiller, 1968
Knipowitschia panizzae(Verga, 1841)
Knipowitschiapunctatissima (Canestrini, 1864)
Gobius niger jozoLinnaeus, 1758
Gobius nigricansCanestrini, 1867
Padogobius martensii(Günther, 1861)
Zosterisessor ophiocephalus(Pallas, 1811) | SPIGOLA*
PERSICO REALE
ORATA*
BAVOSA PAVONE *
CAGNETTA
GHIOZZETTO MARMOREGGIATO*
GHIOZZETTO MINUTO*
GHIOZZETTO CENERINO N
GHIOZZETTO DEL TORTONESE* (I)
GHIOZZETTO DI LAGUNA (N/C)
PANZAROLO (N)
GHIOZZO NERO*
GHIOZZO DI RUSCELLO C
GHIOZZO PADANO (N)
GHIOZZO GO’ |
PLEURONECTIFORMES
Pleuronectidae
Platichthysflesus italicus (Günther, 1862) |
PASSERA* (N)
|
Figura 1. Areale del Triotto (in rosso) e della Rovella (in azzurro); i punti rossi indicano alcune popolazioni introdotte e naturalizzate di Triotto in Italia centro-meridionale.
Figura 2. Areale del Ghiozzo padano (in rosso) e del Ghiozzo di ruscello (in azzurro).

- Figura 3. Rapporti di ibridazione tra la Trota fario di ceppo atlantico e tre semispecie di Salmonidi indigene in Italia.
Oltre alle specie riportate in tabella II, nei fiumi italiani sono presenti anche una quarantina di altre specie ittiche, aliene, intenzionalmente o accidentalmente immesse dall’uomo (NOCITA e ZERUNIAN, 2007); ciò rientra nel fenomeno più generale di alterazione della biodiversità delle acque interne dovuto alla presenza di specie aliene (vedi GHERARDI et al., 2008). Tra i pesci naturalizzati in Italia ci sono la Carpa (Cyprinus carpio), introdotta in epoca romana, e il Carassio dorato (Carassius auratus), introdotto nel XVII secolo; la maggior parte delle specie aliene è stata invece immessa nel corso della seconda metà del Novecento. In generale le specie aliene rappresentano elementi negativi per la biodiversità, perché instaurano rapporti di predazione, competizione o ibridazione con le specie indigene, mettendo a rischio la loro sopravvivenza; in figura 3 viene illustrato il rapporto di ibridazione possibile fra le Trote fario di ceppo atlantico, con cui vengono effettuati la maggior parte dei ripopolamenti dei tratti alti dei corsi d’acqua italiani, e tre semispecie di Salmonidi indigene nel nostro Paese.

- Figura 4. Triotto – Rutilus erythrophthalmus Zerunian, 1982.
Considerando l’alto numero di endemiti e subendemiti, che secondo il quadro tassonomico riportato in tabella II sono in totale 22 (ma che arrivano a 24 se consideriamo anche il Ghiozzetto del Tortonese e la Passera), emerge la notevole importanza faunistica dei pesci dei corsi d’acqua e più in generale delle acque interne d’Italia. Nelle figure 4, 5 e 6 sono illustrate alcune delle specie di pesci d’acqua dolce endemiche in Italia. È evidente che in questo contesto abbiamo la massima parte di responsabilità nella conservazione di un immenso patrimonio in termini di biodiversità. nostro Paese.
Figura 5. Carpione del Fibreno – Salmo fibreni Zerunian e Gandolfi, 1990.
Figura 6. Ghiozzo di ruscello (in alto la femmina, in basso il maschio) – Gobius nigricans Canestrini, 1867
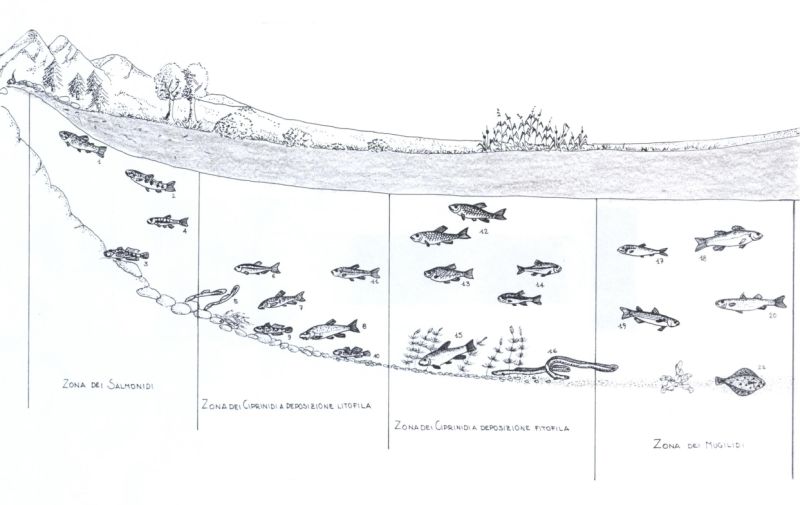
- Figura 7. Nella maggior parte dei corsi d’acqua italiani possono essere identificate 4 zone caratterizzate da una diversa composizione della comunità ittica: Zona dei Salmonidi, Zona dei Ciprinidi a deposizione litofila, Zona dei Ciprinidi a deposizione fitofila, Zona dei Mugilidi. Le specie raffigurate sono le seguenti (è necessario tenere conto che alcune di esse sono esclusive dell’Italia settentrionale ed altre dell’Itala peninsulare): 1. Trota fario, 2. Trota macrostigma, 3. Scazzone, 4. Sanguinerola, 5. Lampreda di ruscello, 6. Vairone, 7. Barbo canino, 8. Barbo, 9. Ghiozzo di ruscello, 10. Ghiozzo padano, 11. Rovella, 12. Cavedano, 13, Scardola, 14. Triotto, 15. Tinca, 16. Anguilla, 17. Alosa, 18. Spigola, 19. Muggine calamita, 20. Cefalo, 21. Passera.
Sono poche le specie capaci di vivere in ogni tratto di un fiume. La distribuzione della gran parte delle piante e degli animali che vivono nei corsi d’acqua è in relazione con le caratteristiche morfologiche e fisico-chimiche proprie dei diversi tratti. È così possibile individuare delle “zone” caratterizzate dalla presenza di alcune specie (e dall’assenza di altre). Diversi gruppi di organismi vengono utilizzati per individuare le diverse zone di un fiume: piante, macroinvertebrati, pesci.
Prendendo in considerazione i pesci, nella maggior parte dei corsi d’acqua italiani possono essere individuate 4 zone (ZERUNIAN, 1982); esse sono caratterizzate dalla presenza di alcune specie con particolari esigenze bio-ecologiche, appartenenti alle famiglie dei Salmonidi, dei Ciprinidi e dei Mugilidi. Ciascuna zona presenta proprie caratteristiche ambientali, che dipendono principalmente dalla pendenza del terreno su cui scorre il fiume, dalla sua portata e dalla vicinanza con il mare; in alcuni corsi d’acqua, in funzione di ripetuti cambiamenti nella pendenza del terreno, le zone dei tratti medio-alti possono alternarsi. La zonazione ittica dei corsi d’acqua italiani è basata sulle seguenti zone (fig. 7):
ZONA DEI SALMONIDI (specie tipiche Trota fario e Trota macrostigma), caratterizzata da acqua dolce, limpida e ben ossigenata; corrente molto veloce, con presenza di rapide; fondo a massi, ciottoli o ghiaia grossolana; scarsa o moderata presenza di piante acquatiche; temperatura fino a 16-17 °C, ma generalmente inferiore.
ZONA DEI CIPRINIDI A DEPOSIZIONE LITOFILA (dal greco lithos = “pietra”; specie tipiche Barbo. Barbo canino, Vairone), che depongono cioè uova e spermatozoi sulla ghiaia, caratterizzata da acqua dolce e limpida, soggetta però a torbide di breve durata, discretamente ossigenata; corrente veloce, alternata a zone dove l’acqua rallenta e la profondità è maggiore; fondo con ghiaia fine e sabbia; moderata presenza di piante acquatiche; temperatura raramente superiore a 19-20 °C.
ZONA DEI CIPRINIDI A DEPOSIZIONE FITOFILA (dal greco phyton = “pianta”; specie tipiche Tinca, Scardola, Triotto), che depongono cioè uova e spermatozoi sulle piante acquatiche, caratterizzata da acqua dolce frequentemente torbida e solo moderatamente ossigenata in alcuni periodi; bassa velocità della corrente; fondo fangoso; abbondanza di piante acquatiche; temperatura fino a 24-25°C.
ZONA DEI MUGILIDI (specie tipiche Cefalo, Muggine calamita, Muggine labbrone), caratterizzata da acqua salmastra in seguito al rimescolamento delle acque dolci fluviali con quelle salate marine; bassa velocità della corrente; fondo fangoso; moderata presenza di piante acquatiche; temperatura, concentrazione di ossigeno e torbidità molto variabili, anche in funzione delle maree.
La zonazione ittica di un corso d’acqua non va considerata in modo rigido, perché non esistono confini netti fra le varie zone e perché alcune specie, come ad esempio l’Anguilla e il Cavedano, possono essere presenti in uno stesso momento in più zone; bisogna poi considerare che in alcuni ambienti particolari, come le risorgive, possono convivere specie normalmente distribuite in zone diverse.
Nelle varie zone di un corso d’acqua i pesci rivestono ruoli importantissimi dal punto di vista trofico, essendo elementi fondamentali di catene e reti alimentari (fig. 8).
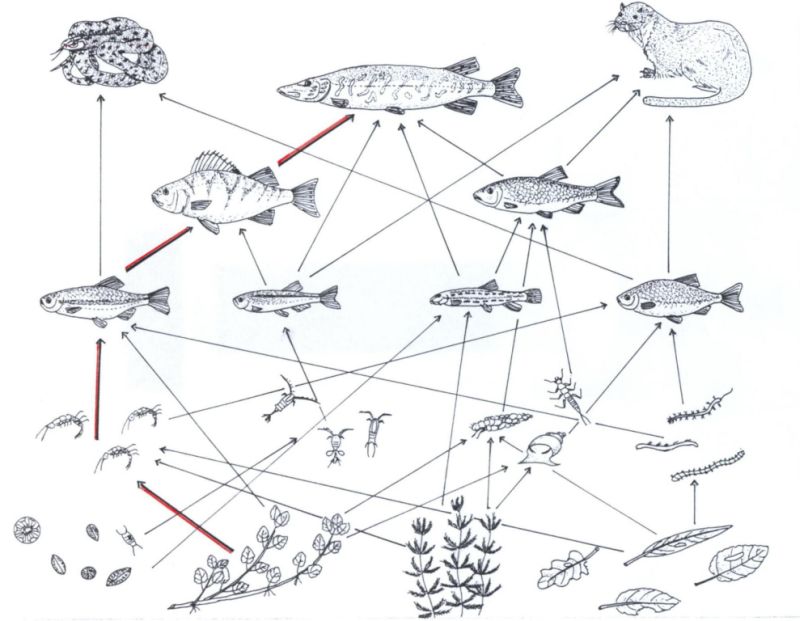
- Figura 8. Schematizzazione di una catena (frecce più spesse) e di una rete alimentare di un ecosistema fluviale.
Stato di conservazione dell'Ittiofauna italiana
Nei Paesi industrializzati i fiumi sono oggetto di molteplici usi da parte dell’uomo, legati a bisogni primari e attività produttive quali l’approvvigionamento di acqua potabile e per gli usi domestici, l’irrigazione dei terreni agricoli, la produzione di energia elettrica, i cicli di produzione industriale, lo smaltimento degli scarichi urbani e industriali in forma liquida, il prelievo di inerti per l’edilizia, la pesca e l’acquacoltura; in molti casi queste utilizzazioni sono in netto contrasto l’una con l’altra, troppo spesso ci sono degli inutili sprechi, quasi sempre non vengono tenute in considerazione le esigenze delle comunità biotiche e delle singole specie. La causa di fondo che minaccia i fiumi e gli organismi che vivono in essi è quindi l’antropizzazione, più o meno elevata, del territorio.
Nella tabella III, ripresa da un nostro precedente lavoro (ZERUNIAN, 2002), vengono riportate le principali attività dell’uomo che minacciano la vita dei fiumi, messe a fuoco in funzione di uno dei gruppi faunistici tra i più rappresentativi all’interno degli ecosistemi fluviali: i pesci. Le attività antropiche che recano danno alle comunità ittiche danneggiano generalmente le intere comunità biotiche; così i pesci rappresentano solo un esempio di una realtà naturale a rischio ben più vasta. Gli effetti di una o più di queste attività su una popolazione, soprattutto se appartenente a una specie stenoecia o migratrice, possono produrre una diminuzione sempre più consistente della densità fino ad arrivare all’estinzione locale (ciò la scomparsa di tutti gli individui che compongono la popolazione); ciò può accadere per esempio in seguito alla costruzione di una diga, alla canalizzazione di un corso d’acqua o alla cementificazione del suo alveo. Le estinzioni locali determinano la riduzione e la frammentazione dell’areale di una specie, rendendo difficili gli scambi genetici fra le popolazioni che la costituiscono; l’isolamento delle popolazioni compromette la loro stessa sopravvivenza in tempi medi (dell’ordine delle decine di anni). Nei pesci d’acqua dolce il rischio è particolarmente alto perché, diversamente da altri animali come ad esempio gli uccelli, la capacità di ricolonizzazione spontanea di un ambiente è generalmente bassa; le estinzioni locali rappresentano così perdite che le specie non sono in grado di colmare in tempi brevi e medi. La somma di più estinzioni locali può avere come ultima conseguenza l’estinzione totale della specie.
Tabella III. Attività dell’uomo e loro conseguenze con effetti deleteri per i pesci dei corsi d’acqua; vengono raggruppate in funzione del tipo di danni che provocano alle comunità ittiche.
I.Danni diretti
con perdita di diversità biologica per rarefazione o estinzione locale di alcune specie
I.1. Inquinamento prodotto dalle attività industriali
I.2. Inquinamento prodotto dalle attività agricole
I.3. Costruzione di sbarramenti trasversali lungo i corsi d’acqua (dighe, chiuse, ecc.)
I.4. Pesca eccessiva e pesca illegale
I.5. Eccessiva captazione di acqua e conseguente riduzione delle portate di torrenti e fiumi
I.6. Immissione di specie aliene predatrici o portatrici di patologie
II.Danni indiretti
con perdita di diversità biologica per rarefazione o estinzione locale di alcune specie, come conseguenza della perdita di diversità ambientale
II.1. Inquinamento prodotto dagli insediamenti urbani e zootecnici
II.2. Canalizzazione dei corsi d’acqua
II.3. Interventi sugli alvei (cementificazioni, prelievi di ghiaia, ecc.)
con variazioni della diversità biologica in seguito a immissioni e ripopolamenti effettuati in modo irrazionale
II.4. Immissione di specie aliene con nicchia ecologica simile a quella di specie indigene e competizione con quest’ultime
II.5. Inquinamento genetico di popolazioni indigene con seguente all’ibridazione con individui della stessa specie o dello stesso genere di origine alloctona immessi per fini di ripopolamento
La valutazione del rischio di estinzione di una specie secondo la IUCN (International Union for Conservation of Nature) è basata su una serie di categorie e di criteri, che vengono periodicamente migliorati; l'ultima versione è del 2001 (vedi www.iucnredlist.org). Le categorie di rischio di estinzione a livello non globale sono 11: Non Valutata (NE), Non Applicabile (NA), Carente di Dati (DD), Minor Preoccupazione (LC), Quasi Minacciata (NT), Vulnerabile (VU), in Pericolo (EN), in Pericolo Critico (CR), Estinta nella Regione (RE), Estinta in Ambiente Selvatico (EW), Estinta (EX). Di queste, tre sono considerate categorie di minaccia: Vulnerabile (VU, Vulnerable), in Pericolo (EN, Endangered), in Pericolo Critico (CR, Critically Endangered); le specie classificate in queste ultime categorie vengono considerate prioritarie nelle politiche di conservazione, perché senza interventi specifici mirati a neutralizzare le minacce nei loro confronti, e in alcuni casi a incrementare le loro popolazioni, la loro estinzione viene considerata una prospettiva concreta.
Lo stato di conservazione dei Pesci d’acqua dolce italiani è stato da noi monitorato con frequenza circa quinquennale negli ultimi vent’anni (ZERUNIAN, 1992, 1998, 2002, 2007), con risultati sempre più preoccupanti. Riprendendo i dati dell’ultimo dei nostri lavori citati, emerge il seguente quadro: 3 specie risultano estinte nei nostri fiumi e laghi (RE, Regionally Extinct: Lampreda di fiume, Storione, Storione ladano); 5 specie, tra cui 4 endemiche o subendemiche, sono in pericolo critico (CR, Critically Endangered: Lampreda di mare, Storione cobice, Trota macrostigma, Carpione del Fibreno, Carpione del Garda); 9 specie, tra cui 4 endemiche o subendemiche, sono in pericolo (EN, Endangered: Lampreda di ruscello, Lampreda padana, Agone, popolazioni indigene di Trota fario, Trota lacustre, Trota marmorata, popolazioni indigene di Temolo, Panzarolo, Ghiozzo di ruscello); 15 specie, tra cui 5 endemiche o subendemiche, sono in condizione vulnerabile (VU, Vulnerable: Alosa, Pigo, Sanguinerola, Savetta, Lasca, Barbo canino, Cobite mascherato, Cobite barbatello, Luccio, Nono, Spinarello, Pesce ago di rio, Scazzone, Cagnetta, Ghiozzo padano); 15 specie sono quasi minacciate (NT, Near Threatened: Anguilla, Rovella, Triotto, Vairone, Alborella, Alborella meridionale, Gobione, Tinca, Scardola, Barbo, Cobite, Persico reale, Ghiozzetto cenerino, Ghiozzetto di laguna, Latterino); una sola specie, il Cavedano, può essere considerata a minor preoccupazione (LC, Least Concern)!
Nella recente Lista Rossa dei Vertebrati Italiani (RONDININI et al., 2013), anche se da noi criticata per vari aspetti relativi ai Pesci d’acqua dolce (ZERUNIAN, 2013), viene riportato un quadro ancor più preoccupante; l’Anguilla, per esempio, è stata inserita nella categoria delle specie “in pericolo critico”. A conferma del quadro illustrato, nell’ultimo monitoraggio delle specie italiane di interesse comunitario svolto in osservanza della Direttiva “Habitat” 92/43/CEE (GENOVESI et al., 2014), delle 28 specie considerate di Ciclostomi e di Pesci Ossei solo 4 sono risultate in uno stato di conservazione favorevole in almeno una delle regioni biogeografiche in cui viene suddiviso il nostro Paese; si tratta di Alburnus albidus, Leuciscus souffia, Knipowitschia panizzae e Pomatoschistus canestrinii.
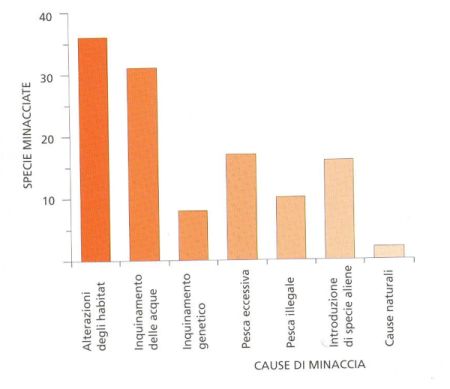
- Figura 9. Incidenza delle varie cause di minaccia per i Pesci d’acqua dolce italiani; in molti casi una specie è minacciata da diverse attività antropiche.
I Pesci d’acqua dolce italiani che possono essere considerati estinti e quelli che corrono i maggiori rischi di estinzione sono riconducibili a tre tipologie zoogeografico-ecologiche: I. specie a distribuzione puntiforme, come il Carpione del Garda e il Carpione del Fibreno; II. specie bentoniche stenoecie a ridotta vagilità, come il Ghiozzo di ruscello, il Ghiozzo padano, il Panzarolo, la Lampreda padana, la Lampreda di ruscello e il Cobite mascherato; III. specie che necessitano di migrazioni riproduttive o comunque di spostamenti entro i corsi d’acqua per raggiungere le zone di frega, come lo Storione, lo Storione cobice, lo Storione ladano, la Lampreda di mare, la Lampreda di fiume, l’Alosa, la Savetta e la Lasca.
Le principali cause antropiche ritenute responsabili della critica situazione in cui versa l’ittiofauna italiana sono, in ordine di importanza: alterazioni degli habitat, inquinamento delle acque, introduzione di specie aliene, pesca condotta in modo eccessivo o con metodi e in tempi illegali, inquinamento genetico (figura 9, da ZERUNIAN, 2002). Per cercare di contrastare la tendenza negativa che riguarda la fauna ittica d’acqua dolce del nostro Paese, abbiamo individuato i taxa di maggiore interesse conservazionistico (Lampreda padana, Storione cobice, Trota macrostigma, Carpione del Fibreno, Trota marmorata, Carpione del Garda, Panzarolo, Ghiozzo di ruscello) ed avanzato proposte finalizzate ad invertire la tendenza in atto e scongiurare il rischio di estinzione che corre una parte consistente e altamente significativa dell’ittiofauna italiana (ZERUNIAN, 2003).
Comunità ittiche e qualità ambientale
L’analisi delle comunità ittiche dei corsi d’acqua può dare un importante contributo alla valutazione della qualità ambientale. Ciò è previsto dal contesto normativo vigente: la Direttiva Quadro sulle Acque 2000/60/CE e il D.L.vo 152/2006 che la recepisce. Queste norme rappresentano una tappa importante nel campo della gestione e della salvaguardia della risorsa idrica e della funzionalità ecosistemica; allo stesso tempo rappresentano delle interessanti opportunità per i contesti territoriali regionali e provinciali, perché rappresentano la base giuridica per impostare politiche capaci di invertire la tendenza negativa di degrado e recuperare un buono stato ecologico degli ecosistemi fluviali e più in generale delle acque interne.
La Direttiva 2000/60/CE è una norma dell'Unione Europea che si prefigge "la protezione delle acque superficiali interne, delle acque costiere e sotterranee che impedisca un ulteriore deterioramento, protegga e migliori lo stato degli ecosistemi acquatici e degli ecosistemi terrestri e delle zone umide direttamente dipendenti dagli ecosistemi acquatici sotto il profilo del fabbisogno idrico" (art. 1 - a), avendo come obiettivo il raggiungimento del "buono stato" delle acque superficiali e sotterranee entro il 2015. Ciò va perseguito attraverso la gestione delle acque a scala di bacino idrografico e l'approfondita conoscenza delle sue caratteristiche, il rispetto degli obiettivi previsti da altre Direttive comunitarie, nonché dai valori limite di emissione e degli standard di qualità ambientale. Tra i fondamenti della Direttiva, oltre al principio di "non deterioramento" contenuto già nell'articolo 1, vi sono i principi di precauzione, prevenzione e "chi inquina paga"; alla base della gestione della risorsa vi è "l'utilizzo idrico sostenibile”.
Per la classificazione dello stato ecologico delle acque superficiali (fiumi, laghi, acque di transizione, acque costiere) la Direttiva individua tre tipologie di elementi qualitativi: elementi biotici; elementi idromorfologici, a sostegno degli elementi biotici; elementi chimico-fisici, a sostegno degli elementi biotici. Risulta evidente il ruolo primario assegnato agli elementi biotici. Per questi ultimi vengono anche individuati i gruppi tassonomico-ecologici da prendere in considerazione: composizione, abbondanza e biomassa del fitoplancton (non per i fiumi); composizione e abbondanza della flora acquatica, macrofite e fitobentos; composizione e abbondanza dei macroinvertebrati bentonici; composizione, abbondanza e struttura di età della fauna ittica (non per le acque costiere).
La parte tecnica della Direttiva 2000/60/CE è contenuta nell’Allegato V: Stato delle acque superficiali. Fra gli elementi biotici qualitativi che la direttiva stabilisce di prendere in considerazione per la classificazione dello stato ecologico (punto 1.1) c’è la composizione, abbondanza e struttura di età della fauna ittica; tali elementi sono specificatamente indicati per i fiumi (punto 1.1.1), i laghi (1.1.2) e le acque di transizione (1.1.3). Nelle tabelle 1.2.1, 1.2.2 e 1.2.3 dello stesso allegato vengono date definizioni dello stato ecologico “elevato, “buono” e “sufficiente” di fiumi, laghi ed acque di transizione; si osservi che mentre per le prime due tipologie ecosistemiche la trattazione è particolareggiata (tabb. 1.2.1 e 1.2.2), per le acque di transizione appare piutosto lacunosa e, per alcuni aspetti, non corrispondente alla realtà (tab. 1.2.3). Nella tabella IV sono riportati i parametri riguardanti la fauna ittica per la classificazione dello stato ecologico di fiumi e laghi.
Tabella IV. Parametri riguardanti la fauna ittica per la classificazione dello stato ecologico di fiumi e laghi secondo la Direttiva 2000/60/CE (tabb. 1.2.1 e 1.2.2 dell’Allegato V).
ELEVATO: Composizione e abbondanza delle specie che corrispondono totalmente o quasi alle condizioni inalterate. Presenza di tutte le specie sensibili alle alterazioni tipiche specifiche. Strutture di età della comunità ittica che presentano segni minimi di alterazioni antropiche e non indicano l’incapacità a riprodursi o a svilupparsi di specie particolari.
|
BUONO: Lievi variazioni della composizione e abbondanza delle specie rispetto alle comunità tipiche specifiche, attribuibili agli impatti antropici sugli elementi di qualità fisico-chimica e idromorfologica. Strutture di età della comunità ittica che presentano segni di alterazioni attribuibili a impatti antropici sugli elementi di qualità fisico-chimica e idromorfologica e, in alcuni casi, indicano l’incapacità a riprodursi
o a svilupparsi di una specie particolare che può condurre alla scomparsa di alcune classi di età
|
SUFFICIENTE: Composizione e abbondanza delle specie si discostano moderatamente dalle comunità tipiche specifiche a causa di impatti antropici sugli elementi di qualità fisico-chimica e idromorfologica. Struttura di età della comunità ittica che presenta segni rilevanti di alterazioni che provocano l’assenza o la presenza molto limitata di una percentuale moderata delle specie tipiche specifiche.
|
Per fornire uno strumento utile all’applicazione della Direttiva 2000/60/CE abbiamo elaborato un indice relativo alla fauna ittica, che si basa e sviluppa gli elementi contenuti nell’Allegato V della norma: l’ISECI, Indice dello Stato Ecologico delle Comunità Ittiche (ZERUNIAN, 2004b, 2007b; ZERUNIAN et al., 2009). In questo indice si tiene conto di due aspetti principali: 1) la naturalità delle comunità, intesa come la normale ricchezza determinata dalla presenza di tutte le specie indigene attese in relazione al quadro zoogeografico ed ecologico e dall’assenza di specie aliene; 2) la buona condizione delle popolazioni indigene, intesa come la capacità di autoriprodursi ed avere normali dinamiche ecologico-evolutive.
L’ultima versione dell’ISECI (ZERUNIAN et al., 2009) è stata riconosciuta dal Ministero dell’Ambiente e della Tutela del Territorio e del Mare come metodo nazionale per il monitoraggio dei corsi d’acqua previsto dalla Direttiva Quadro sulle Acque 2000/60/CE attraverso l’Elemento di Qualità Biologica (EQB) fauna ittica (DM n. 260/2010). La struttura dell’Indice prevede l’esame di 5 indicatori principali, che hanno un peso diverso nel calcolo del valore attribuito a una comunità: presenza di specie indigene, condizione biologica delle popolazioni, presenza di ibridi, presenza di specie aliene, presenza di specie endemiche. Il valore che emerge dal calcolo rappresenta sostanzialmente il risultato della comparazione fra una comunità ittica attesa in un dato tratto di un corso d’acqua e la comunità ittica effettivamente presente in esso. Successivamente si procede alla conversione dei valori dell’ISECI in classi, da I a V corrispondenti a giudizi sintetici che vanno da elevato a cattivo (tab. V).
Tabella V. Classificazione dello stato dell’EQB fauna ittica secondo l’ISECI
Classi | Valore ISECI (F) | Giudizio sintetico sullo stato ecologico delle comunità ittiche | Giudizio esteso sullo stato ecologico delle comunità ittiche | Colore(per larappresentazione cartografica) |
I | 0,8 | Elevato | si veda Zerunian, 2004b | Blu |
II | 0,6 | Buono | si veda Zerunian, 2004b | Verde |
III | 0,4 | Sufficiente | si veda Zerunian, 2004b | Giallo |
IV | 0,2 | Scarso | si veda Zerunian, 2004b | Arancione |
V | 0 | Cattivo | si veda Zerunian, 2004b | Rosso |
A titolo di esempio, viene illustrato un caso di applicazione dell’ISECI. In tabella VI è riportata la sintesi, molto semplificata, di una scheda di campagna; la situazione descritta è teorica.
Tabella VI. Sintesi semplificata di una scheda di campagna.
Corso d’acqua: Fiume Lungo; Stazione “Casale rosso”; 01.04.2014. |
Comunità ittica attesa: Luccio, Scardola, Tinca, Triotto, Cobite. |
Comunità ittica reale (campionata): Luccio (popolazione mediamente strutturata in classi di età, scarsa consistenza demografica, assenza di ibridazione rilevabile dall’esame del fenotipo), Scardola (popolazione ben strutturata inclassi di età, intermedia consistenza demografica), Persico sole, Pseudorasbora. |
Si noti che: a) uno dei pesci indigeni presenti, il Luccio, è una specie di “maggiore importanza ecologico-funzionale”; b) mancano tre delle specie indigene attese (Tinca, Triotto e Cobite), di cui due endemiche in Italia (Triotto e Cobite); c) sono presenti due specie aliene di “media nocività” (Persico sole e Pseudorasbora).
Nella figura 10 viene riportato il percorso che porta al calcolo del valore numerico dell’ISECI. Il valore finale dell’indice, espresso in termini di EQR, è 0,58; pertanto la comunità ittica campionata nella stazione oggetto dell’esempio è in classe III (ossia compreso tra i valori 0,4 e 0,6), a cui corrisponde un giudizio sintetico "sufficiente".
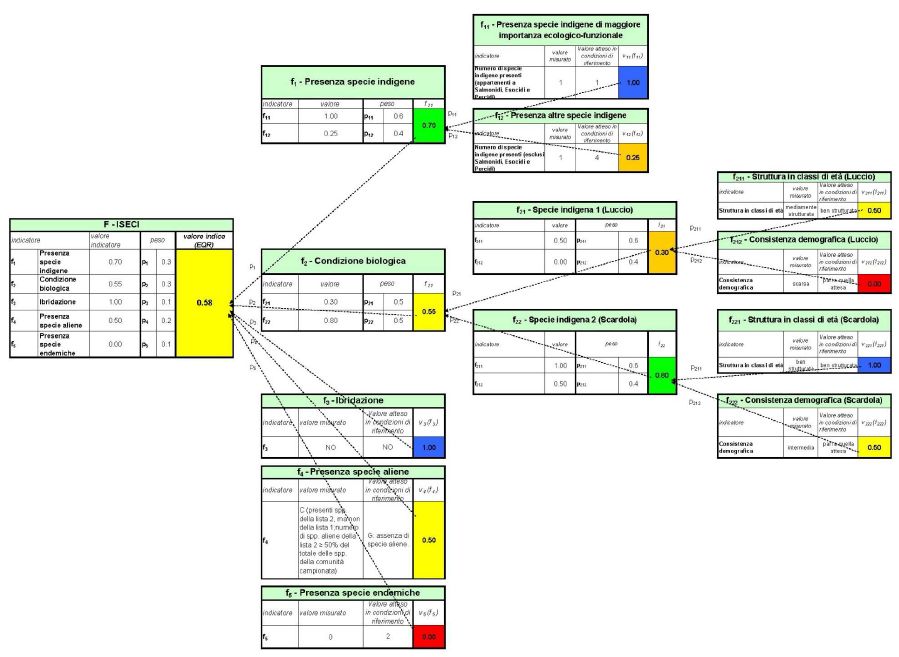
- Figura 10. Percorso esemplificativo che illustra il calcolo del valore numerico dell’ISECI in relazione all'ipotetica comunità ittica descritta in tabella VI. Con questa visualizzazione gli indicatori più “critici”, ovvero più distanti dalle condizioni di riferimento, risultano immediatamente riconoscibili e, conseguentemente, appaiono più facilmente individuabili i problemi da risolvere e le misure più appropriate da prevedere.
Nell’applicazione dell’ ISECI avvenuta negli ultimi anni da parte di ittiologi e tecnici faunisti in numerosi corsi d’acqua di varie regioni d’Italia, sono emerse delle criticità; per alcune di esse, come la corretta individuazione delle comunità ittiche di riferimento e la questione dell’autoctonia della Trota fario, abbiamo proposto delle soluzioni capaci di mantenere l’applicabilità dell’Indice nell’intero territorio nazionale (ZERUNIAN, 2012).
In conclusione la fauna ittica dei corsi d’acqua italiani, oltre a rappresentare un prezioso patrimonio di biodiversità del nostro Paese legato all’alto numero di specie endemiche e subendemiche, costituisce un insieme di elementi bio-ecologici che a vari livelli (popolazioni e comunità) fornisce importanti indicazioni sullo stato dell’ambiente e su cui è possibile impostare programmi di monitoraggio in armonia con la normativa vigente.
Bibliografia
BIANCO P.G., 2014 - An update on the status of native and exotic freshwater fishes of Italy. J. Appl. Ichthyol., 30: 62-77.
GANDOLFI G., ZERUNIAN S., 1987 - I Pesci delle acque interne italiane: aggiornamento e considerazioni critiche sulla sistematica e la distribuzione. Atti Soc. ital. Sci. nat. Museo civ. Stor. nat. Milano, 128 (1-2): 3-56.
GENOVESI P., ANGELINI P., BIANCHI E., DUPRÈ E., ERCOLE S., GIACANELLI V., RONCHI F., STOCH F. (eds.), 2014 - Specie e habitat di interesse comunitario in Italia: distribuzione, stato di conservazione e trend. ISPRA, Serie Rapporti, 194/2014, XVI + 330 pp.
GHERARDI F., BERTOLINO S., BODON M., CASELLATO S., CIANFANELLI S., FERRAGUTI M., LORI E., MURA G., NOCITA A., RICCARDI N., ROSSETTI G., ROTA E., SCALERA R., ZERUNIAN S., TRICARICO E., 2008 - Animal xenodiversity in Italian inland waters: distribution, modes of arrival, and pathways. Biol. Invasions, 10: 435-454.
RONDININI C., BATTISTONI A., PERONACE V., TEOFILI C. (compilatori), 2013 - Lista Rossa dei Vertebrati Italiani. Min. Ambiente e Tutela Terr. e Mare e Comitato Ital. IUCN, 54 pp.
ZERUNIAN S., 1982 - Una proposta di classificazione della zonazione longitudinale dei corsi d’acqua dell’Italia centro-meridionale. Atti XLIX Conv. U.Z.I., Bari (1982) - Boll. Zool., 49 (suppl.): 200.
ZERUNIAN S., 1992 - La perdita di diversità nelle comunità ittiche delle acque dolci. In: Melandri G. e Conte G. (eds.). Ambiente Italia 1992. Lega per l'Ambiente / Vallecchi ed., Firenze, pp. 156-169.
ZERUNIAN S., 1998 - Pesci d'acqua dolce In: Bulgarini F., Calvario E., Fraticelli F., Petretti F., Sarrocco S. (eds.). Libro Rosso degli Animali d'Italia - Vertebrati. WWF Italia, Roma, 210 pp.
ZERUNIAN S., 2002 - Condannati all’estinzione? Biodiversità, biologia, minacce e strategie di conservazione dei Pesci d’acqua dolce indigeni in Italia. Edagricole, Bologna, X + 220 pp.
ZERUNIAN S., 2003 - Piano d’azione generale per la conservazione dei Pesci d’acqua dolce italiani. Ministero dell’Ambiente e Ist. Naz. Fauna Selvatica, Quad. Cons. Natura, 17, 123 pp.
ZERUNIAN S., 2004 - Pesci delle acque interne d’Italia. Ministero dell’Ambiente e Ist. Naz. Fauna Selvatica, Quad. Cons. Natura, 20, 257 pp.+ CD.
ZERUNIAN S., 2004b - Proposta di un Indice dello Stato Ecologico delle Comunità Ittiche viventi nelle acque interne italiane. Biologia Ambientale, 18 (2): 25-30.
ZERUNIAN S., 2007 - Problematiche di conservazione dei Pesci d'acqua dolce italiani. In: Zerunian S. e Genoni P. (eds.). La Fauna Ittica dei Corsi d'Acqua: qualità ambientale, ricerca e conservazione della biodiversità. Biologia Ambientale, 21 (2): 49-55.
ZERUNIAN S., 2007b - Primo aggiornamento dell’Indice dello Stato Ecologico delle Comunità Ittiche. In: Zerunian S. e Genoni P. (eds.). La fauna ittica dei corsi d’acqua: qualità ambientale, ricerca e conservazione della biodiversità Biologia Ambientale, 21 (2): 43-47.
ZERUNIAN S., 2012 - L’Indice dello Stato Ecologico delle Comunità Ittiche: criticità e proposte operative. Biologia Ambientale, 26 (1): 55-58.
ZERUNIAN S., 2013 - Lista Rossa dei Vertebrati Italiani: considerazioni critiche relative ai Pesci d’acqua dolce. Biologia Ambientale, 27 (2): 78-85.
ZERUNIAN S., DE RUOSI T., 2002 - Iconografia dei Pesci delle acque interne d’Italia / Iconography of Italian Inland Water Fishes.